Аутор:
Judy Howell
Датум Стварања:
2 Јули 2021
Ажурирати Датум:
21 Јуни 2024

Садржај
- На корак
- 1. део од 2: Проналажење атомског броја
- 2. део од 2: Проналажење сродних информација
- Савети
Атомски број елемента је број протона у језгру појединог атома тог елемента. Атомски број елемента или изотопа се не мења, па помоћу атомског броја можете израчунати друге карактеристике елемента или изотопа, као што је број неутрона.
На корак
1. део од 2: Проналажење атомског броја
 Пронађите копију периодног система. Овде га можете пронаћи ако га немате при руци. Сваки елемент има другачији атомски број, тако да не постоје брзе и једноставне методе. Или ћете морати да пронађете копију периодног система или да је запамтите.
Пронађите копију периодног система. Овде га можете пронаћи ако га немате при руци. Сваки елемент има другачији атомски број, тако да не постоје брзе и једноставне методе. Или ћете морати да пронађете копију периодног система или да је запамтите. - Већина уџбеника хемије има периодни систем одштампан на унутрашњој страни корице.
 Пронађите елемент који проучавате. Већина периодичних таблица садржи пуна имена различитих елемената, као и њихове хемијске симболе (као што је Хг за живу). Ако имате проблема са проналажењем елемента, претражите „хемијски симбол“ на мрежи, а затим и назив елемента.
Пронађите елемент који проучавате. Већина периодичних таблица садржи пуна имена различитих елемената, као и њихове хемијске симболе (као што је Хг за живу). Ако имате проблема са проналажењем елемента, претражите „хемијски симбол“ на мрежи, а затим и назив елемента.  Пронађите атомски број. Атомски број се обично налази у горњем левом или десном углу оквира који садржи елемент, али се такође може налазити и негде другде у оквиру. Атомски број је увек цео број.
Пронађите атомски број. Атомски број се обично налази у горњем левом или десном углу оквира који садржи елемент, али се такође може налазити и негде другде у оквиру. Атомски број је увек цео број. - Ако је то децимални број, вероватно гледате на атомску масу.
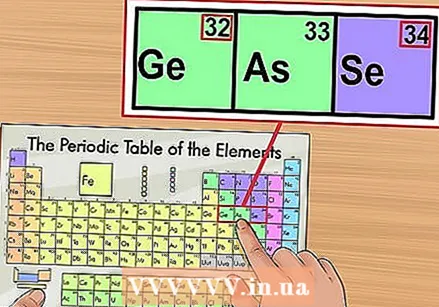 Провери против суседних елемената. Периодни систем је поредан по атомском броју. Ако је атомски број вашег елемента „33“, онда би елемент са леве стране требало да буде „32“, а елемент са десне стране „34“. Ако је овај редослед тачан, апсолутно сте пронашли атомски број.
Провери против суседних елемената. Периодни систем је поредан по атомском броју. Ако је атомски број вашег елемента „33“, онда би елемент са леве стране требало да буде „32“, а елемент са десне стране „34“. Ако је овај редослед тачан, апсолутно сте пронашли атомски број. - После елемената 56 (баријум) и 88 (радијум) може бити празног простора. Заправо нема простора; елементи са атомским бројевима који тамо припадају налазе се у два реда испод остатка система. Једини разлог зашто су толико раздвојени је да периодни систем учине мање широким.
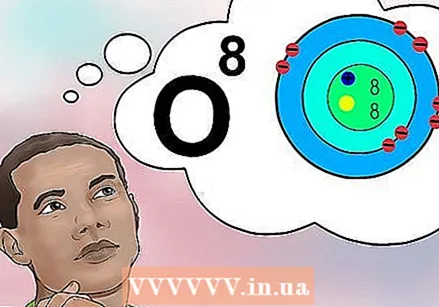 Схватите који је атомски број. Постоји једноставна дефиниција за атомски број елемента: број протона у једном атому тог елемента. Ово је основна дефиниција елемента. Број протона одређује укупан електрични набој језгра, који одређује колико електрона може имати атом. Будући да су електрони одговорни за готово све хемијске реакције, атомски број индиректно одређује готово сва физичка и хемијска својства елемента.
Схватите који је атомски број. Постоји једноставна дефиниција за атомски број елемента: број протона у једном атому тог елемента. Ово је основна дефиниција елемента. Број протона одређује укупан електрични набој језгра, који одређује колико електрона може имати атом. Будући да су електрони одговорни за готово све хемијске реакције, атомски број индиректно одређује готово сва физичка и хемијска својства елемента. - Другим речима, сваки атом са осам протона је атом кисеоника. Два атома кисеоника могу имати различит број неутрона или (ако је један јон) различит број електрона, али оба ће увек имати по осам протона.
2. део од 2: Проналажење сродних информација
 Проналажење атомске тежине. Атомска тежина се обично штампа под називом дотичног елемента на периодном систему и обично се тачно израчунава на две или три децимале. Ово је просечна маса елемента једног атома, прилагођена ономе што ћете вероватно наћи у природи. Овај број је у „јединицама атомске масе“ (АМУ (од енглеског „атомиц масс унит“)).
Проналажење атомске тежине. Атомска тежина се обично штампа под називом дотичног елемента на периодном систему и обично се тачно израчунава на две или три децимале. Ово је просечна маса елемента једног атома, прилагођена ономе што ћете вероватно наћи у природи. Овај број је у „јединицама атомске масе“ (АМУ (од енглеског „атомиц масс унит“)). - Неки научници користе израз „релативна атомска маса“ уместо „атомска тежина“.
 Разумевање атомске масе. Атомска маса је концепт врло сличан концепту атомске тежине. Једина разлика је у томе што говорите о одређеном атому уместо о средњем вредности тест узорка. Грам гвожђа садржи пуно атома са масама које се међусобно мало разликују, па тражите „релативну тежину“ да бисте пронашли средњу вредност. Ако вас занима само један одређени атом гвожђа, не занима вас просек - занима вас само тачна маса тог одређеног атома.
Разумевање атомске масе. Атомска маса је концепт врло сличан концепту атомске тежине. Једина разлика је у томе што говорите о одређеном атому уместо о средњем вредности тест узорка. Грам гвожђа садржи пуно атома са масама које се међусобно мало разликују, па тражите „релативну тежину“ да бисте пронашли средњу вредност. Ако вас занима само један одређени атом гвожђа, не занима вас просек - занима вас само тачна маса тог одређеног атома. - У пракси је атомска маса обично већ дата за хемијске проблеме који се тичу само једног атома. Схватите овај концепт тако да вас не изненади ако се разликује од атомске тежине.
 Заокруживање до масовног броја. Масни број је укупан број протона плус неутрона у једном атому елемента. Овај број можете лако пронаћи: само узмите атомску тежину наведену у периодном систему и заокружите на најближи цео број.
Заокруживање до масовног броја. Масни број је укупан број протона плус неутрона у једном атому елемента. Овај број можете лако пронаћи: само узмите атомску тежину наведену у периодном систему и заокружите на најближи цео број. - Ово функционише јер су неутрони и протони око 1 АМУ, а електрони близу 0 АМУ. Прецизна мерења користе се за атомску тежину да би се добио децимални број, али нас занимају само цели бројеви који нам говоре о броју протона и неутрона.
- Запамтите, коришћење атомске тежине даће вам просек за типични узорак. Узорак брома има масени број од око 80, али као што се може видети, један атом брома готово увек има масени број од 79 или 81.
 Израчунати број неутрона. Сада знате да је атомски број = број протона, а да је масени број = број протона + број неутрона. Да бисте сазнали колико неутрона постоји у елементу, морате да одузмете атомски број од масеног броја. Ево неколико примера:
Израчунати број неутрона. Сада знате да је атомски број = број протона, а да је масени број = број протона + број неутрона. Да бисте сазнали колико неутрона постоји у елементу, морате да одузмете атомски број од масеног броја. Ево неколико примера: - Један атом хелијума (Хе) има масени број 4 и атомски број 2. Стога мора бити 4 - 2 = 2 неутрона имати.
- Узорак сребра (Аг) има масени број око 108 (према периодном систему) и атомски број 47. У просеку сваки атом сребра у узорку има 108 - 47 = 61 неутронима.
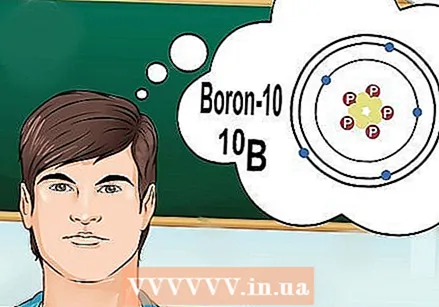 Схватите шта су изотопи. Изотоп је специфичан облик елемента са одређеним бројем неутрона. Када се хемијско питање односи на „бор-10“ или „Б“, они се односе на елемент бора са масеним бројем 10. Користите овај масени број уместо „типичне“ вредности бора.
Схватите шта су изотопи. Изотоп је специфичан облик елемента са одређеним бројем неутрона. Када се хемијско питање односи на „бор-10“ или „Б“, они се односе на елемент бора са масеним бројем 10. Користите овај масени број уместо „типичне“ вредности бора. - Изотопи немају другачији атомски број. Сваки изотоп елемента има једнак број протона.
Савети
- Неки тежи елементи имају атомску тежину која је затворена у заграде или заграде. То значи да је атомска тежина тачна маса најстабилнијег изотопа, а не просек вишеструких изотопа. (Ово нема утицаја на атомски број елемента.)



